Тест по молекулярной физике
Поделиться:
1. Какова среднеквадратическая скорость молекул азота (м/с) при температуре 7°С? (М=28 г/моль, k = 1,38•10-23Дж/К)
- 1. 840
- 2. 500
- 3. 720
- 4. 900
2. Как изменится давление газа, если его объем уменьшится в 2 раза, а среднеквадратическая скорость его молекул уменьшится в √2 раз
- 1. уменьшится в 8 раз
- 2. не изменится
- 3. увеличится в 4 раза
- 4. уменьшится в 4 раза
3. Укажите, в каком из ответов наиболее полно представлены основные положения молекулярно-кинетической теории строения вещества?
- 1. вещество состоит из элементарных частиц и они взаимно превращаются друг в друга
- 2. вещество состоит из мельчайших частиц и между ними действуют силы
- 3. вещество состоит из маленьких частей и они заполняют пространство
- 4. все тела состоят из молекул или атомов, которые непрерывно и хаотически движутся, между молекулами и атомами действуют силы притяжения и отталкивания.
4. Какова масса одной молекулы воды (г), если ее молярная масса равна 18 г?
- 1. 10-23
- 2. 3•10-23
- 3. 3•10-24
- 4. 10-26
5. Определите отношение числа молекул в 36 г воды к числу молекул в 2 г водорода.
- 1. 0,5
- 2. 1
- 3. 2
- 4. 3
6. Оцените, во сколько примерно раз среднее расстояние между молекулами в газах при нормальных условиях больше размеров самих молекул газа.
- 1. 80-100
- 2. 800-1000
- 3. 8000-10000
- 4. 8-10
7. Число Авогадро:
1) равно 6,02•1023 моль-1;
2) это число атомов в 12 г углерода;
3) равно числу молекул в одном моле любого вещества;
4) равно числу молекул в 22,4 л любого газа, находящегося при нормальных условиях.
1) равно 6,02•1023 моль-1;
2) это число атомов в 12 г углерода;
3) равно числу молекул в одном моле любого вещества;
4) равно числу молекул в 22,4 л любого газа, находящегося при нормальных условиях.
- 1. 1 и 2
- 2. 1, 2, 3 и 4
- 3. 1 и 4
- 4. 1, 2 и 3
8. Средняя кинетическая энергия теплового движения молекул:
1) зависит от температуры;
2) не зависит от температуры;
3) зависит от массы молекул;
4) не зависит от массы молекул;
5) зависит от агрегатного состояния вещества;
6) не зависит от агрегатного состояния вещества.
1) зависит от температуры;
2) не зависит от температуры;
3) зависит от массы молекул;
4) не зависит от массы молекул;
5) зависит от агрегатного состояния вещества;
6) не зависит от агрегатного состояния вещества.
- 1. 2, 3 и5
- 2. 1, 3 и 5
- 3. 1, 4 и 6
- 4. 2, 3 и 6
9. Во сколько раз увеличится среднеквадратическая скорость молекул идеального газа при повышении абсолютной температуры в 2 раза?
- 1. 2√2
- 2. √2
- 3. 2
- 4. 4
10. Какое количество вещества (ноль) содержится в 144 г воды? ?(Н)=1 а.е.м., ?(O)=16 а.е.м.
- 1. 6
- 2. 8
- 3. 4
- 4. 10
11. При какой температуре (К) среднеквадратическая скорость атомов гелия будет такой же, как и среднеквадратическая скорость молекул водорода при температуре 300 К?
- 1. 50
- 2. 400
- 3. 100
- 4. 600
12. Чему равна масса (кг) одной молекулы медного купороса CuSO4, если атомные массы меди, серы и кислорода равны соответственно 64, 32 и 16 а.е.м., а число Авогадро составляет 6•1023моль-1
- 1. 2,67•10-25
- 2. 2•10-22
- 3. 2•10-23
- 4. 26,7•10-23
13. Оцените среднеквадратическую скорость молекул водорода при температуре 80 К (м/с), к = 1,38•10-23Дж/К.
- 1. 500
- 2. 1200
- 3. 1000
- 4. 800
14. Какое количество вещества (моль) содержится в 98 г серной кислоты H2SO4? Относительные атомные массы водорода, серы и кислорода равны соответственно 1,32 и 16 а.е.м.
- 1. 0,5
- 2. 1,5
- 3. 2
- 4. 1
15. Плотность воздуха при нормальных условиях равна 1,29 кг/м3. Определите молярную массу воздуха (кг/моль):
- 1. 29•10-3
- 2. 0,29•10-3
- 3. 2,9•10-3
- 4. 29•10-2
16. От какой из приведенных ниже величин, характеризующих молекулы, зависит давление идеального газа?
- 1. силы притяжения между молекулами
- 2. кинетической энергии молекул
- 3. силы отталкивания между молекулами
- 4. потенциальной энергии взаимодействия молекул
17. Определите плотность воздуха (кг/м3) при температуре 17°С и давлении 100 кПа? Молярная масса воздуха 29 г/моль.
- 1. 1,7
- 2. 1,2
- 3. 2,9
- 4. 29
18. Какой процесс изображен на графике? Как изменится плотность газа при переходе из состояния 1 в состояние 2?
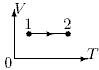

- 1. изохорный; увеличится
- 2. изохорный; уменьшится
- 3. изотермический; не изменится
- 4. изохорный; не изменится
19. Идеальный газ перешел из одного состояния в другое по закону P1/T1 = P2/T2. На каких рисунках правильно показан этот процесс?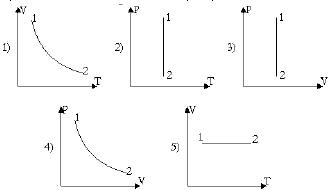

- 1. 3 и 5
- 2. 3 и 4
- 3. 2 и 4
- 4. 2 и 3
20. При использовании газа, находящегося в металлическом баллоне его давление уменьшилось на 75%. Во сколько раз уменьшилась масса газа? Считать, что Т = const.
- 1. 4
- 2. 1,33
- 3. 14
- 4. 2
21. При нормальных условиях газ занимает объем 10 л. Какой объем (л) займет этот газ, если давление увеличить в 5 раз? Температура постоянна.
- 1. 2
- 2. 3
- 3. 4
- 4. 5
22. Во сколько раз увеличится давление идеального газа, находящегося в закрытом сосуде при температуре 27°С, если его нагреть до 627°С?
- 1. 2
- 2. 1,18
- 3. 3
- 4. 2,21
23. Сравните средние кинетические энергии атомов гелия (М=4 г/моль) при температуре T(E1) и неона (М=20 г/моль) при температуре 2,5Т(Е2).
- 1. Е1=2,5Е2
- 2. Е2=2,5Е1
- 3. Е1=Е2
- 4. Е2=5Е1
24. Какова масса воздуха (г), если он занимает объем 8,3 л при нормальном давлении и температуре 17°С? Рн=105Па, М=29 г/моль, R=8,3 Дж/моль•К.
- 1. 100
- 2. 50
- 3. 500
- 4. 10
25. В каких единицах измеряется абсолютная влажность воздуха в системе СИ?
- 1. %
- 2. безмерна
- 3. K
- 4. кг/м3
26. Идеальный газ перешел из состояния 1 в состояние 2. Сопоставьте давление газа в состояниях 1 и 2.
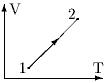

- 1. возможно P1 > P2 или P2> P1
- 2. P2>P1
- 3. Р1 = P2
- 4. Р1 > P2
27. Как изменится средняя кинетическая энергия теплового движения молекул идеального газа в некотором процессе, если концентрацию молекул уменьшить в 10 раз, а температуру увеличить в 2 раза?
- 1. уменьшится в 10 раз
- 2. увеличится в 2 раза
- 3. уменьшится в 5 раз
- 4. увеличится в 5 раз
28. Среди приведенных графиков укажите изотерму.
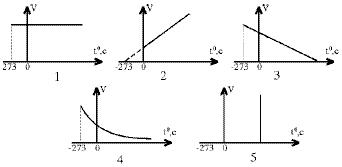

- 1. 1
- 2. 5
- 3. 2
- 4. 3
29. На рисунке приведены три изотермы для одной и той же массы газа. Какая изотерма соответствует наибольшей температуре?
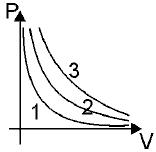

- 1. 3
- 2. 2
- 3. все изотермы соответствуют одной и той же температуре
- 4. 1
30. Как изменяется температура газа при его адиабатическом сжатии?
- 1. может как уменьшаться, так и увеличиваться
- 2. не изменяется
- 3. понижается
- 4. повышается
31. На рисунке приведены три изохоры для одной и той же массы газа. Какая изохора соответствует наибольшему объему?
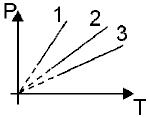

- 1. 3
- 2. 1
- 3. все изохоры соответствуют одному и тому же объему
- 4. 2
32. В идеальном газе пренебрегают:
1) размерами молекул;
2) массой молекул;
3) хаотическим движением молекул;
4) столкновениями молекул;
5) взаимодействием молекул на расстоянии.
1) размерами молекул;
2) массой молекул;
3) хаотическим движением молекул;
4) столкновениями молекул;
5) взаимодействием молекул на расстоянии.
- 1. 2 и 3
- 2. 1 и 2
- 3. 1 и 5
- 4. 3 и 4
33. Среди приведенных ниже математических выражений укажите все записи основного уравнения молекулярно-кинетической теории идеального газа: 1) pV= (m/M)RT; 2) Е = (3/2)kT; 3) р = nkT; 4) р = (1/3)??2
- 1. 3 и 4
- 2. 1 и 2
- 3. 1 и 3
- 4. 2 и 4
34. Укажите все соотношения, справедливые для изобарного процесса 1) V/T= const; 2) VТ = const; 3) V1/V2=T1/T2; 4) р1/р2=Т1/Т2; 5) V1/T2 = V2/T1.
- 1. 2 и 4
- 2. 1 и 3
- 3. 2 и 5
- 4. 1, 4 и 5
35. Какое из приведенных выражений является уравнением изобарного процесса?
- 1. P=2/3nEk
- 2. P1V1=P2V2
- 3. PV=m/?RT
- 4. V1/T1=V2/T2
36. Одинаковые воздушные шары заполнены до одинаковых давлений первый – водородом, второй – азотом, третий – гелием. Какой из них имеет наименьшую подъемную силу? Наполненный…
- 1. водородом
- 2. гелием
- 3. азотом
- 4. все имеют одинаковую подъемную силу
37. Сосуд заполнен смесью водорода, азота и углекислого газа и герметично закрыт. У какого газа средняя квадратическая скорость молекул наибольшая?
- 1. углекислого газа
- 2. азота
- 3. ответ зависит от объема сосуда
- 4. водорода
38. Определите относительную влажность воздуха φ(%) при температуре 24°С, если точка росы равна 9°С. Давления насыщенных паров при точке росы и данной температуре соответственно равны 1,14 кПа и 2,96 кПа.
- 1. 48
- 2. 41
- 3. 30
- 4. 34
39. Какая точка на приведенной диаграмме соответствует минимальной температуре идеального газа (1-2 и 4-5 – изобары, 3-4 и 5-1 – изохоры, 2-3 – изотерма).
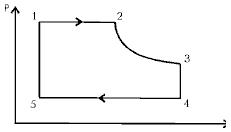

- 1. 5
- 2. 2
- 3. 3
- 4. 1
40. Неизвестный газ массой 0,5 г при температуре (-23°С) создает в баллоне давление 60 кПа. В этом же баллоне кислород массой 50 г при температуре 47°С создал бы давление 480 кПа. Найдите молярную массу неизвестного газа (г/моль).
- 1. 2
- 2. 4
- 3. 28
- 4. 18
41. Давление газа, заключенного в объеме 1 м3 при температуре 300 К равно 280 кПа. Оцените температуру этого газа (К) при давлении 160 кПа и объеме 2 м3.
- 1. 250
- 2. 300
- 3. 343
- 4. 450
42. На сколько градусов надо поднять температуру газа, находящегося в баллоне, чтобы его давление увеличилось в 2 раза? Начальная температура газа 127°С.
- 1. 400
- 2. 127
- 3. 327
- 4. 600
43. Определите относительную влажность воздуха φ(%) при температуре 32°С, если точка росы равна 11°С. Давления насыщенных паров при точке росы и данной температуре соответственно равны 1,33 кПа и 4,73 кПа.
- 1. 39
- 2. 30
- 3. 34
- 4. 36
44. Герметичный цилиндр длиной I разделен пополам тонким и невесомым поршнем, который может перемещаться без трения. Закрепив поршень в этом положении, обе половины цилиндра заполнили идеальным газом так, чтобы давление в одной половине было в два раза больше, чем в другой. На какое расстояние сместится поршень, если его освободить? Процесс считать изотермическим.
- 1. I/4
- 2. 2I/5
- 3. I/6
- 4. I/3
45. В двух одинаковых по объему сосудах при одинаковой температуре находится по 1 молю двух разных газов, причем масса молекул m1> m2. Укажите правильные утверждения.
1) Средние кинетические энергии молекул обоих газов одинаковы.
2) Средние квадратичные скорости молекул обоих газов одинаковы.
3) Давления газов p1> р2.
4) Концентрации молекул n1= n2.
1) Средние кинетические энергии молекул обоих газов одинаковы.
2) Средние квадратичные скорости молекул обоих газов одинаковы.
3) Давления газов p1> р2.
4) Концентрации молекул n1= n2.
- 1. 1 и 4
- 2. только 1
- 3. только 2
- 4. 1, 2
46. Давление насыщенного при постоянной температуре пара зависит…
- 1. от рода пара
- 2. от давления воздуха
- 3. от массы пара
- 4. от объема, занимаемого паром
47. В трех сосудах одинакового объема содержатся по 6 молей Н2, O2 и СO2. Каково соотношение давлений газов, если они имеют одинаковую температуру?
- 1.
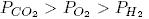
- 2.
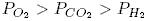
- 3.
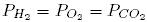
- 4.
48. Определите относительную влажность воздуха φ(%) при температуре 22°С, если точка росы равна 9°С. Давления насыщенных паров при точке росы и данной температуре соответственно равны 1,14 кПа и 2,62 кПа.
- 1. 51
- 2. 58
- 3. 45,5
- 4. 40
49. На рисунке в координатных осях p-V изображен график процесса изменения состояния идеального газа. Какой из графиков в координатных осях р-Т соответствует этому процессу?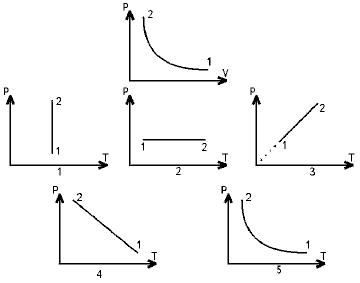

- 1. 4
- 2. 2
- 3. 3
- 4. 1
50. При изотермическом процессе давление газа увеличилось в два раза. Как изменилась концентрация молекул газа в сосуде?
- 1. уменьшилась в 2 раза
- 2. уменьшилась в 4 раза
- 3. увеличилась в 2 раза
- 4. увеличилась в 4 раза